Les cellules cancéreuses croissent et se divisent continuellement, nécessitant ainsi un apport énergétique constant. Une étude récente explore comment le cancer tire son carburant des cellules graisseuses et identifie un mécanisme potentiel pour affamer la tumeur de sa nutrition.
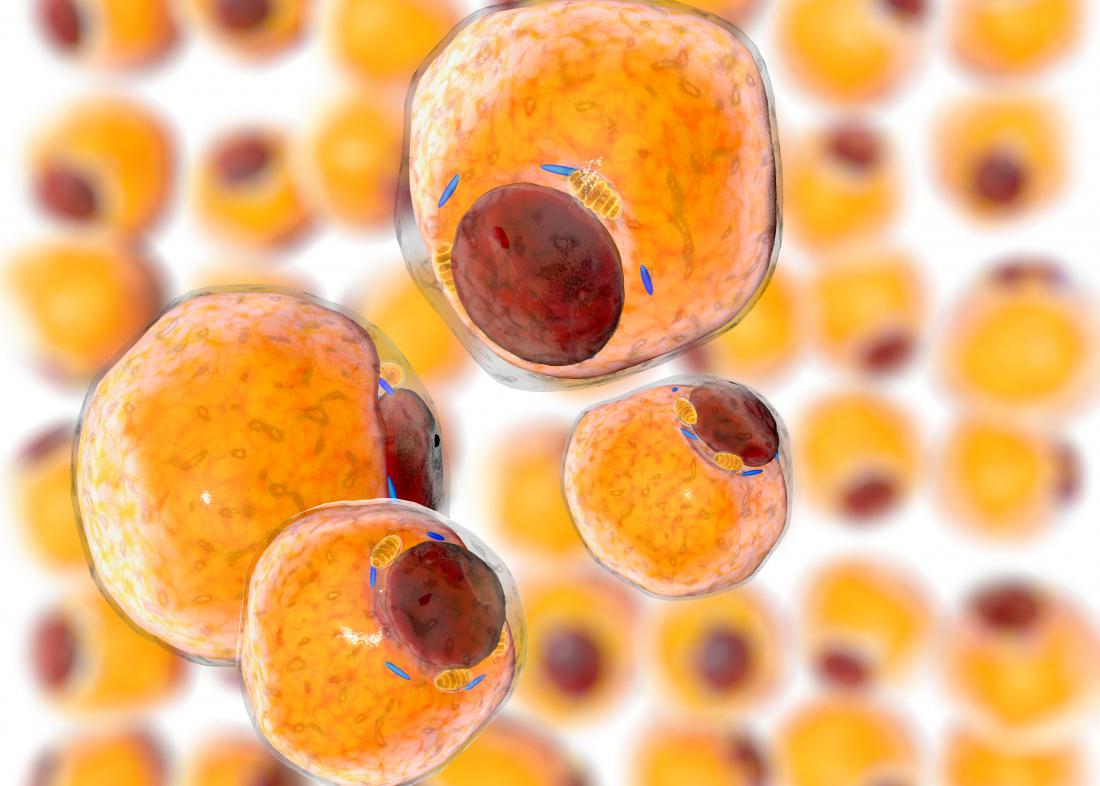
Le cancer est un domaine d’étude de plus en plus complexe, chaque angle d’attaque étant scruté par les chercheurs. Malgré des millions d’heures d’expérimentation, de nombreuses questions demeurent sans réponse.
À mesure que nous approfondissons notre compréhension du cancer, il devient évident qu’il doit être abordé comme une maladie du corps entier. Pour survivre et prospérer, le cancer puise de l’énergie dans les cellules et les tissus environnants, exploitant le système circulatoire tout en évitant la détection par le système immunitaire. Les tumeurs doivent naviguer habilement pour soutenir leur croissance et s’intégrer harmonieusement dans l’organisme.
Les chercheurs concentrent désormais leurs efforts non seulement sur les cellules cancéreuses elles-mêmes, mais aussi sur les systèmes que les tumeurs utilisent pour maintenir leur existence.
Tumeur, Métabolisme et Graisse
Les scientifiques du Sanford Prebys Medical Discovery Institute à San Diego, Californie, s’intéressent tout particulièrement à la manière dont les tumeurs interagissent avec les cellules graisseuses. Maria Diaz-Meco, Ph.D., co-auteure de l’étude, souligne l’importance de cette recherche.
« Nous devons élargir notre vision, » déclare-t-elle. « Il est crucial d’explorer des aspects de la thérapeutique du cancer au-delà des seules génétiques, en investissant dans la recherche sur le métabolisme du cancer, qui peut révéler des vulnérabilités communes à tous les types de cancers. »
Cette ligne de recherche est essentielle. Comme le précise Diaz-Meco, « cela conduira finalement à de meilleures thérapies, moins sensibles à la résistance, un problème trop fréquent dans les approches ciblées sur l’oncogénétique ».
Aux États-Unis, le cancer de la prostate est la deuxième cause de décès par cancer chez les hommes. L’obésité est reconnue comme un facteur de risque majeur et prédit un comportement agressif du cancer. Cependant, le mécanisme exact par lequel l’obésité aggrave les résultats du cancer de la prostate reste encore flou.
De nombreuses études ont examiné l’obésité et le cancer de la prostate en utilisant des souris nourries avec un régime riche en graisses. Jorge Moscat, Ph.D., co-auteur de l’étude, explique pourquoi cette approche a ses limites.
« Bien que cela imite certaines conditions cliniques chez les patients, » explique-t-il, « cela ne permet pas une compréhension réelle des voies de signalisation qui régulent la communication bidirectionnelle entre les tumeurs et les adipocytes, ou cellules graisseuses. »
« C’est une étape cruciale, » ajoute Moscat, « si nous voulons identifier des cibles thérapeutiques capables d’interrompre les signaux pro-tumorigènes émanant du tissu adipeux. »
Moscat et Diaz-Meco ont abordé ce défi sous un nouvel angle : ils ont utilisé un modèle de souris dépourvue d’une protéine spécifique, connue sous le nom de p62, dans ses cellules graisseuses. Ces souris, déficientes en p62, deviennent obèses même lorsqu’elles suivent un régime standard.
Leurs découvertes fascinantes sont désormais publiées dans une revue scientifique.
Les Tumeurs Utilisent des Cellules Graisseuses pour le Carburant
Les chercheurs ont découvert que la p62 joue un rôle crucial dans la communication entre le tissu adipeux et les tumeurs. Cette protéine semble soutenir le « métabolisme » du cancer, favorisant ainsi la progression et les métastases en inhibant une seconde protéine appelée mTORC1.
Lorsque mTORC1 est supprimé, les activités énergétiques des cellules graisseuses, telles que la phosphorylation oxydative et le métabolisme des acides gras dans le tissu adipeux blanc, sont également réduites. Avec la cessation de ces processus, davantage d’acides gras et d’autres nutriments deviennent disponibles pour la tumeur, lui permettant de croître et de se développer.
« Cette reprogrammation métabolique orchestrée par la perte de p62 dans les adipocytes semble aider les tumeurs à répondre aux exigences énergétiques d’un cancer agressif, » conclut Maria Diaz-Meco.
Dans des expériences complémentaires, l’équipe a démontré qu’un manque de p62 favorise également la production de Cpt1a et d’ostéopontine, qui aident les cellules cancéreuses à proliférer et à se propager.
Dans le cas du cancer de la prostate particulièrement agressif et résistant à la castration, des niveaux élevés de Cpt1a et d’ostéopontine sont observés.
Ces résultats pourraient avoir des implications significatives pour les futurs traitements du cancer. Comme le souligne Moscat, « l’impact est considérable, car nous identifions un nouvel ensemble de cibles thérapeutiques qui, si elles sont modulées, devraient bloquer la capacité du tissu adipeux activé à promouvoir la malignité tumorale. »
Actuellement, les inhibiteurs de mTOR sont utilisés pour traiter plusieurs cancers. Cependant, des inquiétudes subsistent quant à la possibilité que cela puisse bloquer le métabolisme des tissus adipeux, alimentant ainsi la croissance tumorale dans certains cas.
Néanmoins, des études supplémentaires seront nécessaires pour confirmer ces hypothèses.
Nouvelles Perspectives de Recherche
L’exploration continue des interactions entre le tissu adipeux et le cancer est cruciale. En 2024, plusieurs études prometteuses se concentrent sur les mécanismes biochimiques qui sous-tendent ces relations complexes. Par exemple, des recherches récentes indiquent que les adipokines, des protéines sécrétées par les cellules graisseuses, pourraient influencer la progression tumorale. Des essais cliniques sont également en cours pour évaluer l’efficacité des thérapies ciblant spécifiquement la communication entre les adipocytes et les cellules tumorales.
De plus, l’impact du mode de vie et de l’alimentation sur le métabolisme tumoral est de plus en plus reconnu. L’intégration d’approches diététiques pourrait jouer un rôle clé dans la modulation des interactions entre le cancer et le tissu adipeux, ouvrant ainsi de nouvelles voies pour la prévention et le traitement.
En somme, alors que la recherche avance, il est essentiel de continuer à explorer ces dynamiques complexes afin de développer des stratégies thérapeutiques innovantes et efficaces contre le cancer.