Les enzymes jouent un rôle fondamental en accélérant les réactions chimiques dans le corps humain. Elles se lient aux molécules et les modifient de manière spécifique, ce qui les rend essentielles pour des processus vitaux tels que la respiration, la digestion, ainsi que les fonctions musculaires et nerveuses, parmi de nombreuses autres fonctions.
Dans cet article, nous allons clarifier ce qu’est une enzyme, comment elle fonctionne, et fournir quelques exemples courants d’enzymes présentes dans le corps humain.
Les bases
Les enzymes sont constituées de protéines repliées dans des formes complexes et sont présentes dans tout le corps. Ces protéines catalysent les réactions chimiques qui sont nécessaires à notre survie, contribuant ainsi au métabolisme, qui est l’ensemble des réactions chimiques qui nous maintiennent en vie.
Les enzymes accélèrent (catalysent) les réactions chimiques; dans certains cas, elles peuvent augmenter la vitesse des réactions de millions de fois par rapport à des réactions sans leur intervention.
Un substrat se lie au site actif d’une enzyme, où il est converti en produits. Une fois que ces produits quittent le site actif, l’enzyme est prête à se fixer à un nouveau substrat et à répéter le processus, démontrant ainsi leur efficacité et leur importance.
Que font les enzymes?
Le système digestif dépend fortement des enzymes qui aident le corps à décomposer des molécules complexes en unités plus simples, comme le glucose, permettant ainsi leur utilisation comme source d’énergie.
En matière de réplication de l’ADN, chaque cellule de votre corps contient de l’ADN. Lorsqu’une cellule se divise, cet ADN doit être copié. Les enzymes sont essentielles dans ce processus, facilitant le déroulement des hélices d’ADN et la copie de l’information génétique.
Les enzymes hépatiques jouent également un rôle crucial, car le foie décompose les toxines dans le corps en utilisant une gamme variée d’enzymes pour assurer un métabolisme efficace.
Comment fonctionnent les enzymes
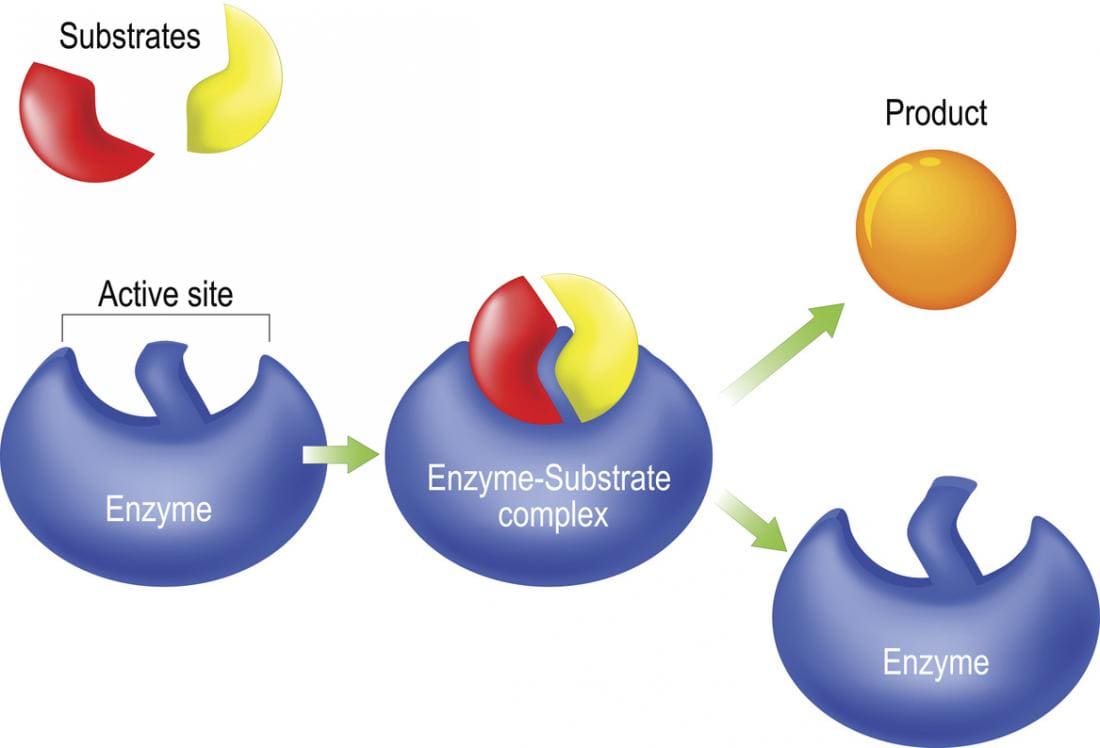
Le modèle de « verrouillage et clé » a été introduit pour la première fois en 1894, stipulant que le site actif d’une enzyme possède une forme spécifique, permettant uniquement au substrat approprié de s’y lier, semblable à une clé dans une serrure.
Cependant, ce modèle a évolué vers le modèle d’ajustement induit, qui suggère que le site actif d’une enzyme change de forme lors de l’interaction avec le substrat. Une fois le substrat parfaitement ajusté, la catalyse peut démarrer.
Les conditions parfaites
Pour que les enzymes fonctionnent de manière optimale, elles nécessitent des conditions spécifiques. La plupart des enzymes dans le corps humain fonctionnent idéalement à environ 37 °C, correspondant à la température corporelle. À des températures plus basses, elles continuent de fonctionner, mais leur efficacité diminue considérablement.
De plus, le pH joue un rôle essentiel. Les enzymes ont des préférences de pH selon leur localisation. Par exemple, celles des intestins fonctionnent mieux à un pH de 7,5, tandis que celles de l’estomac préfèrent un environnement acide, autour de pH 2.
Si la température dépasse un seuil critique ou si l’environnement devient trop acide ou alcalin, l’enzyme peut changer de forme, rendant le site actif inopérant, ce qui entraîne sa dénaturation.
Cofacteurs
Certaines enzymes nécessitent la présence de molécules spécifiques non protéiques appelées cofacteurs pour fonctionner. Par exemple, l’anhydrase carbonique, qui régule le pH du corps, n’est active que lorsqu’elle est liée à un ion zinc.
Inhibition
Pour maintenir un bon fonctionnement des systèmes corporels, il est parfois nécessaire de ralentir l’activité enzymatique. Par exemple, si une enzyme produit trop de produits, il est crucial de réduire ou d’arrêter cette production.
L’activité des enzymes peut être inhibée de plusieurs façons :
- Inhibiteurs compétitifs : une molécule bloque le site actif, et le substrat doit alors rivaliser avec l’inhibiteur pour se lier à l’enzyme.
- Inhibiteurs non compétitifs : une molécule se fixe à l’enzyme en dehors du site actif, diminuant ainsi son efficacité.
- Inhibiteurs mixtes : l’inhibiteur se lie à la fois à l’enzyme et au substrat, ralentissant la réaction.
- Inhibiteurs irréversibles : ces inhibiteurs se lient de façon permanente à l’enzyme, l’inactivant.
Exemples d’enzymes spécifiques
Il existe des milliers d’enzymes dans le corps humain. Voici quelques exemples significatifs :
- Lipases : un groupe d’enzymes qui facilitent la digestion des graisses dans l’intestin.
- Amylase : transforme les amidons en sucres; on la trouve dans la salive.
- Maltase : également présente dans la salive; elle décompose le maltose en glucose, le maltose étant présent dans des aliments comme les pommes de terre, les pâtes et la bière.
- Trypsine : localisée dans l’intestin grêle, elle dégrade les protéines en acides aminés.
- Lactase : également dans l’intestin grêle, elle hydrolyse le lactose en glucose et galactose.
- Acétylcholinestérase : décompose le neurotransmetteur acétylcholine dans les nerfs et les muscles.
- Helicase : démêle l’ADN.
- ADN polymérase : synthétise l’ADN à partir des désoxyribonucléotides.
En un mot
Les enzymes jouent un rôle énorme dans le fonctionnement quotidien du corps humain. En se liant à des composés et en les modifiant, elles sont essentielles pour le bon fonctionnement du système digestif, du système nerveux, des muscles et bien plus encore. Grâce à leur incroyable diversité et leur efficacité, les enzymes sont véritablement le moteur des réactions biochimiques qui soutiennent la vie.
Recherche et Perspectives Récentes (2024)
Les recherches récentes mettent en lumière l’importance croissante des enzymes dans le développement de traitements médicaux innovants. Par exemple, des études récentes ont démontré que des enzymes spécifiques peuvent être utilisées pour cibler des maladies génétiques en corrigeant les mutations au niveau de l’ADN. Des essais cliniques en cours explorent l’utilisation d’enzymes pour améliorer la biodisponibilité des médicaments, permettant ainsi une meilleure absorption et efficacité thérapeutique.
De plus, l’impact des enzymes sur la santé métabolique a été largement étudié. Une enquête récente a révélé que l’optimisation des niveaux d’enzymes digestives peut conduire à une amélioration significative de la santé intestinale et à la prévention de troubles métaboliques, tels que l’obésité et le diabète de type 2. Ces découvertes ouvrent de nouvelles voies pour des interventions nutritionnelles personnalisées, visant à améliorer la santé globale.
Enfin, de nouvelles enzymes découvertes dans des organismes extrêmes pourraient offrir des solutions innovantes pour la biotechnologie, notamment dans la production de biocarburants et de bioplastiques. La recherche est en plein essor, et les applications potentielles des enzymes dans diverses industries sont prometteuses, soulignant leur rôle crucial dans l’avenir de la science et de la médecine.








