La protonthérapie, également appelée thérapie par faisceau de protons, est une forme avancée de thérapie par particules. Elle dirige des faisceaux de protons avec une grande précision sur les cellules cancéreuses.
Considérée comme l’une des techniques de radiothérapie les plus avancées aujourd’hui, elle détruit les cellules cancéreuses tout en minimisant les dommages aux tissus sains environnants, contrairement à la radiothérapie traditionnelle.
En protonthérapie, un faisceau de protons à haute énergie est utilisé pour administrer une dose de radiothérapie ciblée aux patients atteints de cancer, remplaçant ainsi les rayons X utilisés dans la radiothérapie conventionnelle.
Qu’est-ce que la protonthérapie
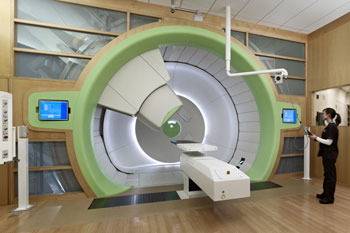
Un portique de traitement par protonthérapie, tel que celui-ci au Roberts Proton Therapy Center, permet de fournir des faisceaux de protons précis aux tumeurs difficiles d’accès. Crédit photo : Roberts Proton Therapy Centre de Penn Medicine et Ed Cunicelli.
La protonthérapie se distingue de la radiothérapie classique par son approche plus ciblée, réduisant ainsi le risque d’endommager les tissus sains autour de la tumeur. Ce traitement s’avère particulièrement approprié pour certains types de cancers, notamment ceux localisés près d’organes vitaux comme les yeux, le cerveau et la moelle épinière.
Dans le cadre de la radiothérapie traditionnelle, ces tumeurs délicates ne peuvent pas être traitées sans risque de lésion des tissus environnants, notamment des nerfs.
La protonthérapie peut également être utilisée pour traiter des cancers touchant :
- le système nerveux central (SNC)
- les yeux
- la tête et le cou
- les poumons, le foie ou la prostate
- les tissus mous de la colonne vertébrale et du bassin, connus sous le nom de sarcome
- les tumeurs cérébrales non cancéreuses
Le MD Anderson Center de l’Université du Texas décrit la protonthérapie comme une machine à cancer de 196 tonnes, capable de cibler les tumeurs tout en préservant les tissus sains environnants et en minimisant les effets secondaires. C’est la définition même de la protonthérapie.
Bien que la protonthérapie soit souvent considérée comme une méthode de traitement plus ciblée, des débats subsistent quant à son avantage par rapport à des thérapies moins coûteuses.
Protonthérapie versus radiothérapie standard
La Société américaine d’oncologie clinique (ASCO) affirme que la protonthérapie peut réduire de jusqu’à 60 % la quantité de radiation reçue par les tissus sains voisins tout en délivrant une dose plus importante à la tumeur elle-même.
Le praticien peut déterminer précisément le moment et l’endroit où le proton libère la majeure partie de son énergie, un phénomène appelé le « pic de Bragg ». Cela permet d’infliger un maximum de dommages aux cellules cancéreuses tout en protégeant les tissus environnants.
Dans la radiothérapie standard, les faisceaux de rayons X libèrent de l’énergie tout au long de leur trajectoire avant d’atteindre leur cible, ce qui entraîne des dommages aux tissus environnants. Cela crée ce qu’on appelle la « dose de sortie ».
En d’autres termes, bien que le traitement cible les cellules cancéreuses, il affecte également les tissus situés le long du faisceau de rayons X, ce qui peut engendrer des problèmes de santé à long terme.
Avec la protonthérapie, le praticien peut administrer une dose de radiation plus élevée que dans la radiothérapie conventionnelle, tout en protégeant les tissus environnants et les organes vitaux.
Dans le cadre de la radiothérapie standard, il est souvent nécessaire de réduire la dose pour minimiser les dommages aux cellules saines.

Comme illustré dans le diagramme ci-dessus, le faisceau de protons (en bleu) cause moins de dommages avant d’atteindre la tumeur, et pratiquement aucun au-delà. En revanche, le faisceau de rayons X (en rouge) diffuse le rayonnement avant et après le site tumoral, causant des dommages à des niveaux beaucoup plus élevés.
La protonthérapie s’adapte à la forme de la tumeur
Les tumeurs présentent une grande variété de formes, de tailles et de localisations, chaque cas étant unique. Grâce à un matériel spécifique, les radiologues peuvent sculpter le faisceau de protons pour qu’il épousent les contours de la tumeur, peu importe sa forme.
Les protons peuvent frapper la tumeur sous différents angles, garantissant ainsi que les dommages aux cellules environnantes sont minimisés, ce qui réduit le risque de complications souvent associées à la radiothérapie.
Applications
Les raisons de choisir la protonthérapie peuvent être classées en deux grandes catégories.
Premièrement, lorsque des dosages plus élevés sont nécessaires : La protonthérapie est utilisée pour les tumeurs qui requièrent des doses de radiation plus élevées, un processus connu sous le nom d’augmentation des doses.
Dans certains cas, cette augmentation de la dose a produit de meilleurs résultats pour les patients par rapport à la radiothérapie classique.
Les types de cas réussis comprennent :
- les sarcomes non résécables
- le mélanome uvéal (tumeurs oculaires)
- les tumeurs paraspinales (chondrosarcome et chordome, à proximité de la colonne vertébrale)
Deuxièmement, pour réduire les effets secondaires indésirables : La protonthérapie peut atténuer le risque d’effets secondaires en limitant les dommages aux tissus normaux et sains, même si la dose est équivalente à celle de la radiothérapie conventionnelle.
Des exemples de situations où cela peut être bénéfique incluent le cancer de la prostate et les cancers touchant la prostate, la colonne vertébrale, la tête et le cou.
La protonthérapie est particulièrement efficace pour traiter les cancers infantiles, car elle cible les cellules cancéreuses sans nuire aux autres cellules dans un corps en développement. Les enfants qui reçoivent une radiothérapie traditionnelle courent un risque accru de retard de croissance.
Protonthérapie utilisée avec d’autres thérapies
Selon l’Association nationale pour la protonthérapie, celle-ci peut être combinée avec « la radiothérapie traditionnelle, la chimiothérapie et/ou comme suivi chirurgical ».
En 2014, une équipe d’oncologues a rapporté dans une revue que la protonthérapie «offrait un gain supplémentaire» aux patients atteints de lymphome de Hodgkin au stade précoce après une radiothérapie ganglionnaire.
Risque de cancer secondaire
La radiothérapie traditionnelle est associée à un risque élevé de cancers secondaires.
En 2013, une étude a été menée pour déterminer si la protonthérapie, par rapport à la radiothérapie traditionnelle (radiothérapie conformationnelle), augmentait le risque de cancer secondaire dans les organes normaux chez les patients atteints de neuroblastomes.
Les neuroblastomes sont des cancers qui se développent à partir de cellules nerveuses immatures situées dans différentes parties du corps humain, souvent près des glandes surrénales.
Les résultats ont montré que les doses de rayonnement mesurées dans les organes sains étaient plus faibles chez les patients traités par protonthérapie par rapport à ceux recevant une radiothérapie traditionnelle.
Les chercheurs ont conclu que, bien que la radiothérapie traditionnelle augmente le risque de cancer secondaire dans la plupart des organes, la protonthérapie semble le réduire.
Quoi attendre
La procédure débute par une simulation.
Simulation
L’équipe médicale, généralement composée d’un radio-oncologue et d’une infirmière en radiothérapie, concevra et équipera le patient d’un appareil permettant de maintenir son corps immobile pendant le traitement.
Le type d’appareil utilisé dépendra de l’emplacement de la tumeur. Les patients atteints de cancer de la tête porteront un masque adapté, tandis qu’un dispositif de berceau sera fabriqué pour ceux dont la zone cible est le corps, la jambe ou le bras.
Une IRM ou un scanner sera effectué pour cartographier la zone à traiter. L’équipe marquera l’emplacement sur la peau où le faisceau doit être dirigé.
Le traitement par protons commence généralement jusqu’à 10 jours après la simulation, et les marques sur la peau ne doivent pas être lavées.
Traitement

Le patient est positionné dans un dispositif en forme de beignet, connu sous le nom de portique, qui tourne autour de lui et dirige les protons directement sur la tumeur.
Un synchrotron ou cyclotron génère et accélère les protons, qui sont ensuite dirigés vers les cellules cancéreuses par des aimants.
Durant la séance, le radiothérapeute se trouve dans une autre pièce, mais il peut voir et communiquer avec le patient via un interphone et une télévision en circuit fermé.
Le traitement prend généralement moins de 2 minutes et ne devrait pas provoquer d’inconfort.
Après la séance, le radiothérapeute revient pour retirer le dispositif qui maintenait le patient immobile.
La protonthérapie est une procédure ambulatoire. Selon le type de cancer, les traitements peuvent s’étendre sur plusieurs semaines.
Des effets secondaires peuvent survenir, bien qu’ils soient généralement légers par rapport aux effets indésirables de la radiothérapie par rayons X. On peut observer des rougeurs autour de la zone traitée et une perte de cheveux temporaire.
Recherches récentes et perspectives pour 2024
À l’approche de 2024, de nouvelles études continuent d’évaluer l’efficacité et la sécurité de la protonthérapie. Des recherches récentes ont montré une amélioration significative des résultats cliniques dans le traitement des cancers pédiatriques, où la protection des tissus sains est cruciale pour le développement futur des enfants.
Une étude menée par une équipe de l’Université de Harvard a révélé que les patients traités par protonthérapie pour des tumeurs cérébrales avaient un taux de survie de 90 % après cinq ans, comparativement à 75 % pour ceux ayant reçu une radiothérapie conventionnelle. Ces résultats encouragent les oncologues à recourir davantage à cette méthode.
En outre, l’essor des technologies d’imagerie avancées permet désormais une planification plus précise des traitements, ce qui optimise encore les résultats de la protonthérapie. Les chercheurs explorent également la possibilité d’associer la protonthérapie à des traitements immunothérapeutiques, offrant ainsi un espoir pour de nouveaux protocoles de soin.
En somme, la protonthérapie émerge comme une option prometteuse et en constante évolution dans le paysage du traitement du cancer, avec des recherches en cours qui pourraient transformer l’approche thérapeutique pour les années à venir.








