La tumeur de Wilms, également désignée comme néphroblastome, constitue un type rare de cancer rénal. Elle touche principalement les enfants, généralement avant l’âge de 6 ans, et est extrêmement rare chez les adultes.
Nommée d’après le médecin allemand Max Wilms, qui l’a décrite pour la première fois en 1899, c’est la tumeur rénale la plus fréquente chez les enfants de moins de 15 ans.
Cet article fournira des informations essentielles sur les tumeurs de Wilms, y compris leur définition, les signes et symptômes, le diagnostic et les traitements disponibles.
Faits rapides sur la tumeur de Wilms
Voici quelques points clés à retenir concernant la tumeur de Wilms :
- La tumeur de Wilms est un cancer du rein rare qui concerne principalement les enfants.
- Le pronostic pour les patients atteints de tumeur de Wilms est généralement favorable.
- Les symptômes comprennent un abdomen gonflé et la présence de sang dans l’urine.
- Des facteurs génétiques peuvent être impliqués, et certaines tumeurs peuvent commencer à se développer in utero.
- Le traitement implique souvent une intervention chirurgicale, une chimiothérapie et parfois une radiothérapie.
- Environ 500 cas sont signalés chaque année aux États-Unis.
Qu’est-ce qu’une tumeur de Wilms ?
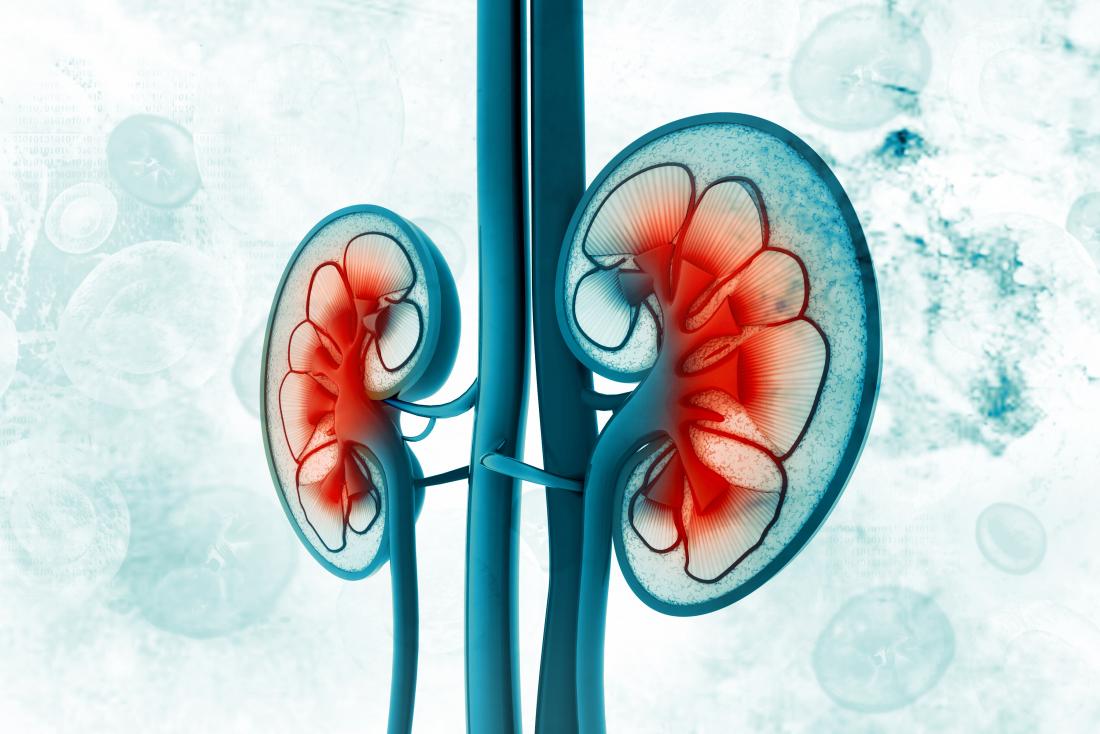
Les tumeurs de Wilms sont rares, mais elles représentent les tumeurs malignes les plus courantes des reins chez les enfants. Si une tumeur est détectée chez un enfant, il y a 90% de chances qu’il s’agisse d’une tumeur de Wilms.
Ces tumeurs surviennent généralement entre l’âge de 3 et 4 ans, et très rarement après l’âge de 6 ans. Chaque année, environ 500 cas sont signalés aux États-Unis.
Plus des trois quarts des cas concernent des enfants en bonne santé, tandis qu’un quart est associé à d’autres problèmes de développement.
Le traitement de la tumeur de Wilms présente un taux de réussite élevé, avec plus de 90% des enfants ayant reçu un traitement survivant au moins 5 ans.
Dans 95% des cas, la tumeur affecte un rein, bien qu’il puisse y avoir plusieurs tumeurs. Dans environ 5% des cas, les deux reins peuvent être touchés. On pense que la tumeur se développe à partir de cellules rénales immatures.
Les tumeurs semblent résulter de l’inactivation ou de la perte d’un gène suppresseur de tumeur, appelé QT1, situé sur le chromosome 11. Les gènes suppresseurs de tumeurs régulent la croissance cellulaire et inhibent la prolifération tumorale.
Symptômes
Au début, il peut n’y avoir aucun symptôme, même si la tumeur est assez volumineuse et indolore. Cependant, la plupart des tumeurs sont détectées avant qu’elles ne commencent à se propager.
Lorsque des symptômes apparaissent, ils peuvent inclure :
- un gonflement abdominal
- du sang dans les urines et une couleur anormale de celles-ci
- de la fièvre
- une perte d’appétit
- de l’hypertension
- des douleurs abdominales ou thoraciques
- des nausées
- de la constipation
- des veines distendues visibles à travers l’abdomen
- un malaise général
- des vomissements
- une perte de poids inexpliquée
Si la tumeur s’est propagée aux poumons, des symptômes tels que la toux, la présence de sang dans les crachats et des difficultés respiratoires peuvent également survenir.
Traitement
Le traitement de la tumeur de Wilms dépend de plusieurs facteurs, notamment :
- l’âge de l’enfant
- son état de santé général
- ses antécédents médicaux
- l’étendue de la maladie
- la tolérance à certains médicaments ou procédures
- les préférences des parents
En règle générale, le traitement standard inclut une chirurgie, une chimiothérapie et parfois une radiothérapie.
Étant donné la rareté de la tumeur de Wilms, il est souvent recommandé que le traitement soit effectué dans un centre de cancérologie pédiatrique.
Chirurgie
Les options chirurgicales comprennent la néphrectomie, qui consiste à retirer le tissu rénal :
- Néphrectomie simple : le rein entier est retiré chirurgicalement. L’autre rein peut suffire à maintenir le patient en bonne santé.
- Néphrectomie partielle : la tumeur et une partie du tissu rénal environnant sont enlevées. Cela est fait si l’autre rein n’est pas en parfait état ou a déjà été enlevé.
- Néphrectomie radicale : l’ensemble du rein, la glande surrénale adjacente, les ganglions lymphatiques et d’autres tissus environnants sont retirés.
Au cours de l’intervention, le chirurgien peut examiner les deux reins et la cavité abdominale, prélevant des échantillons pour analyse.
Autres options
Parmi les autres options, on trouve :
- Transplantation rénale : si les deux reins doivent être retirés, la dialyse sera nécessaire jusqu’à ce qu’une greffe puisse être réalisée.
- Chimiothérapie : les cellules tumorales sont analysées pour déterminer si elles sont agressives ou sensibles à la chimiothérapie, qui utilise des médicaments pour détruire les cellules cancéreuses. Les médicaments cytotoxiques empêchent la division et la prolifération des cellules malignes.
- La chimiothérapie cible principalement les cellules cancéreuses, mais peut affecter également les cellules saines, entraînant divers effets secondaires.
Les effets secondaires peuvent inclure :
- chute de cheveux
- perte d’appétit
- faible nombre de globules blancs
- nausées
- vomissements
Après le traitement, ces effets secondaires disparaissent généralement.
Des chimiothérapies à haute dose peuvent détruire les cellules de la moelle osseuse. Si une forte dose est nécessaire, des cellules de la moelle peuvent être prélevées, congelées puis réintroduites par voie intraveineuse après traitement.
La radiothérapie utilise des faisceaux de rayons X à haute énergie ou des particules pour détruire les cellules cancéreuses en endommageant leur ADN, ce qui les empêche de se reproduire.
La radiothérapie débute généralement quelques jours après l’opération. Les patients très jeunes peuvent recevoir un sédatif pour rester immobiles durant la séance. Le médecin marque la zone cible avec un colorant tout en protégeant les autres parties du corps.
Les effets secondaires potentiels comprennent :
- diarrhée : surtout si l’abdomen est traité, les symptômes peuvent survenir quelques jours après le début.
- fatigue : c’est le symptôme le plus fréquent.
- nausées : pouvant survenir à tout moment durant le traitement. Il est crucial d’en informer le médecin, car cela peut être traité efficacement.
- irritation cutanée : les zones ciblées peuvent devenir rouges et douloureuses, nécessitant une protection contre le soleil, le froid, les frottements et les savons parfumés.
Mise en scène
La stadification permet de déterminer l’étendue de la propagation du cancer :
Stade 1 : le cancer peut généralement être complètement retiré par chirurgie et est limité au rein.
Stade 2 : le cancer a atteint les tissus et structures proches des reins, comme les vaisseaux sanguins, mais peut toujours être complètement enlevé chirurgicalement.
Stade 3 : le cancer s’est propagé aux ganglions lymphatiques voisins ou à d’autres parties de l’abdomen, rendant l’ablation complète plus compliquée.
Stade 4 : le cancer s’est propagé à d’autres parties du corps, y compris potentiellement le cerveau, le foie ou les poumons.
Stade 5 : les deux reins présentent des cellules cancéreuses.
Traitement par étapes
Les traitements peuvent être administrés en fonction du stade du cancer :
Stades 1 ou 2 : si le cancer n’est pas agressif, le rein, les tissus environnants et quelques ganglions lymphatiques voisins seront retirés chirurgicalement, suivi par une chimiothérapie. Dans certains cas, le stade 2 peut également nécessiter une radiothérapie.
Stades 3 ou 4 : si le cancer s’est propagé dans l’abdomen, l’enlèvement pourrait endommager des vaisseaux sanguins ou d’autres structures critiques. Une combinaison de chirurgie, radiothérapie et chimiothérapie sera alors envisagée. La chimiothérapie peut être administrée avant la chirurgie pour réduire la taille de la tumeur.
Stade 5 : si les deux reins sont touchés, une partie de la tumeur de chaque rein sera enlevée, pendant que les ganglions lymphatiques voisins seront examinés pour vérifier la présence de cellules cancéreuses. Ensuite, le patient recevra une chimiothérapie pour réduire la tumeur restante avant une éventuelle chirurgie supplémentaire. L’objectif sera de préserver autant de tissu rénal sain que possible, suivi par d’autres traitements de radiothérapie et chimiothérapie.
Causes
La cause exacte de la tumeur de Wilms demeure inconnue, mais elle semble commencer avant la naissance, lorsque certaines cellules rénales ne se développent pas correctement. Ces cellules anormales prolifèrent dans leur état primitif, formant ainsi une tumeur généralement détectable autour de 3 à 4 ans.
Facteurs génétiques : les gènes régulant la croissance cellulaire peuvent subir des mutations, permettant aux cellules de se diviser de manière incontrôlée. Deux gènes ont été particulièrement étudiés : Wilms Tumor 1 (WT1) et Wilms Tumor 2 (WT2). D’autres chromosomes peuvent également être concernés.
Antécédents familiaux : bien que des tumeurs de Wilms puissent résulter d’un défaut génétique héréditaire, la majorité des cas ne sont pas héréditaires. Moins de 2% des cas impliquent un parent proche.
La plupart des tumeurs de Wilms surviennent sporadiquement, dues à des mutations génétiques affectant la croissance cellulaire dans le rein, généralement après la naissance.
Conditions cooccurrentes
Syndrome de WAGR : Dans quelques cas, une tumeur de Wilms apparaît avec d’autres conditions génétiques. WAGR désigne quatre conditions :
- la tumeur de Wilms
- aniridie : l’absence de l’iris ou de la partie colorée de l’œil
- malformations génito-urinaires
- retard de développement cognitif
WAGR se produit lorsque le gène WT1 est perdu ou inactivé sur le chromosome 11, un gène qui freine la croissance tumorale.
Une personne atteinte du syndrome WAGR a entre 45 et 60% de chances de développer une tumeur de Wilms.
Syndrome de Denys-Drash (DDS) : Ce trouble rare entraîne une insuffisance rénale avant 3 ans et un développement anormal des organes sexuels, avec un risque accru de développer d’autres types de cancer, à l’exception de la tumeur de Wilms, causé par une inactivation du gène WT1.
Syndrome de Beckwith-Wiedemann : Ce trouble de surcroissance présente une variété de symptômes, tels qu’un poids à la naissance significativement plus élevé avec une grande langue, des organes hypertrophiés (surtout le foie), une croissance asymétrique, et un risque accru de développer une tumeur de Wilms ainsi que d’autres cancers comme l’hépatoblastome.
Autres facteurs
D’autres éléments peuvent accroître le risque de développer une tumeur de Wilms :
Sexe : les filles ont un risque légèrement supérieur à celui des garçons.
Origine ethnique : les personnes d’origine africaine ont une probabilité légèrement plus élevée de développer des tumeurs de Wilms, tandis que les Américains d’origine asiatique présentent le risque le plus faible.
Cryptorchidie : la non-descente d’un ou des deux testicules dans le scrotum peut augmenter le risque de tumeur de Wilms.
Hypospadias : les garçons nés avec un urètre mal positionné ont un risque accru de développer cette tumeur.
Diagnostic
Lors du diagnostic, le médecin posera des questions sur les symptômes, vérifiera les antécédents médicaux de l’enfant et réalisera un examen physique.
Les tests suivants peuvent aider à diagnostiquer une tumeur de Wilms :
- Test sanguin : ne peut pas diagnostiquer la tumeur, mais fournit des informations sur l’état général de santé, y compris le foie et les reins.
- Test d’urine : évalue la présence de sucre, protéines, sang et bactéries.
- Échographie abdominale : permet d’examiner les tissus mous et les cavités, fournissant une vue des reins et de toute tumeur éventuelle.
- Imagerie : des techniques comme le scanner ou l’IRM peuvent être utilisées pour évaluer la propagation de la maladie.
- Radiographie pulmonaire : utilisée pour vérifier si le cancer s’est propagé aux poumons.
- Biopsie : prélèvement d’un petit échantillon de la tumeur pour examen microscopique.
Perspective
La tumeur de Wilms peut avoir un pronostic favorable ou défavorable. Si elle est classée comme anaplasique, cela indique un pronostic moins bon et un traitement plus complexe. L’anaplasie se caractérise par des noyaux cellulaires déformés et de grande taille.
D’autres facteurs peuvent influencer le pronostic :
- le stade du cancer
- la taille de la tumeur primaire
- l’âge et la santé générale au moment du diagnostic
- la réponse à la thérapie et la possibilité d’une intervention chirurgicale
- la tolérance aux médicaments et traitements spécifiques
- la présence de changements génétiques
Une thérapie rapide et agressive est souvent la clé d’un bon résultat, tandis que le suivi médical demeure crucial.
Pour les enfants de moins de 15 ans au moment du diagnostic, le taux de survie à 5 ans ou plus était de 88% en 2010, comparé à 74% en 1975.
Selon l’American Cancer Society, les chances de survie pendant au moins 4 ans sont :
Pour un diagnostic au stade 1 : 83% pour une tumeur anaplasique et 99% pour une histologie favorable.
Pour un diagnostic au stade 5 : 55% pour une tumeur anaplasique et 87% pour une histologie favorable.
Essais cliniques
Les essais cliniques peuvent être envisagés si un traitement ne montre pas les résultats escomptés. Les personnes intéressées peuvent trouver plus d’informations sur ces essais cliniques ici.
Recherche récente sur la tumeur de Wilms (2024)
Les avancées dans la recherche sur la tumeur de Wilms ont été prometteuses, en particulier dans l’identification de marqueurs génétiques qui pourraient aider à prédire la réponse au traitement. Des études récentes ont montré que certaines mutations dans le gène WT1 pourraient influencer le pronostic et la réponse à la chimiothérapie.
En 2024, des essais cliniques explorent l’utilisation de thérapies ciblées qui pourraient améliorer les résultats pour les enfants atteints de tumeurs anaplasiques, qui sont souvent plus difficiles à traiter. Les premières données indiquent que ces thérapies pourraient réduire les effets secondaires tout en maintenant l’efficacité du traitement.
De plus, des recherches sur des approches immunothérapeutiques commencent à gagner du terrain. Ces stratégies visent à renforcer le système immunitaire de l’enfant pour qu’il puisse mieux combattre la tumeur, offrant ainsi une nouvelle voie d’espoir pour ceux qui n’ont pas bien répondu aux traitements conventionnels.
En conclusion, l’optimisme est de mise concernant le traitement de la tumeur de Wilms, avec des efforts continus pour améliorer la compréhension de ce cancer et développer des traitements plus efficaces et moins invasifs.








