La leucémie myéloïde aiguë (LMA) est un type de cancer du sang particulièrement agressif, touchant tant les enfants que les adultes. Son développement rapide peut entraîner des conséquences graves si elle n’est pas traitée rapidement.
Également désignée sous le nom de leucémie aiguë myéloblastique ou leucémie aiguë non lymphocytaire (ANLL), la LMA est une pathologie qui mérite toute notre attention.
En 2017, on estimait à 21 380 le nombre de nouveaux cas de LMA diagnostiqués aux États-Unis, un chiffre qui a sans doute évolué ces dernières années. La prévalence de cette maladie est majoritairement observée chez les personnes de plus de 50 ans, et elle touche plus fréquemment les hommes que les femmes.
Avec une prise en charge médicale appropriée, environ 60 à 70 % des adultes atteints de LMA peuvent espérer atteindre une rémission complète.
Qu’est-ce que la leucémie myéloïde aiguë?
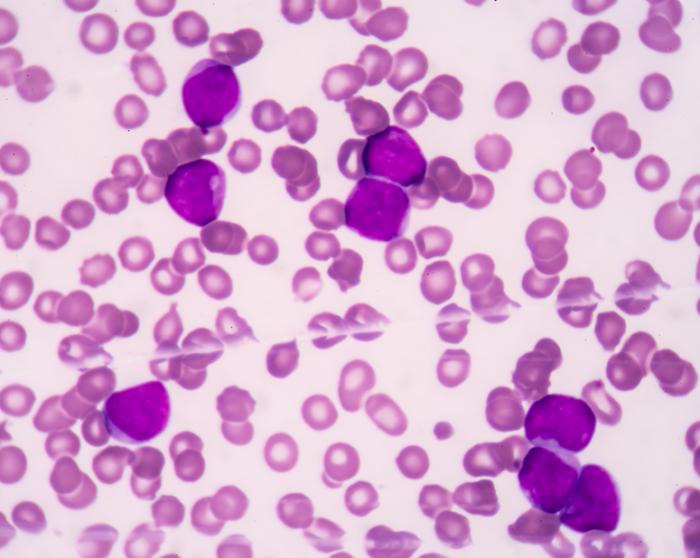
La leucémie aiguë se manifeste de manière soudaine, contrastant avec la leucémie chronique qui évolue lentement. La LMA, en particulier, est caractérisée par une prolifération rapide de globules blancs immatures non fonctionnels dans le sang et la moelle osseuse.
Cette maladie maligne remplace rapidement les cellules sanguines saines, engendrant des signes cliniques préoccupants. Les symptômes peuvent apparaître de manière progressive, avec une aggravation de l’intensité à mesure que les cellules immatures, appelées blastes, envahissent le système sanguin.
Symptômes
Les symptômes de la LMA peuvent inclure :
- une forte fièvre
- un grand nombre d’infections sur une courte période
- essoufflement
- fatigue intense et confusion
- hyperhidrose (transpiration excessive)
- douleurs articulaires et osseuses
- pâleur de la peau
- ecchymoses fréquentes
- troubles de l’élocution
- hépatomégalie (foie enflé)
- lymphadénopathie (ganglions lymphatiques enflés)
- splénomégalie (rate enflée)
- saignements inexpliqués, notamment du nez ou des gencives
- perte de poids inexpliquée
Si les cellules leucémiques envahissent le système nerveux central (SNC), des symptômes neurologiques tels que des maux de tête, une vision floue, des étourdissements, des convulsions et des vomissements peuvent survenir.
Causes et facteurs de risque
Les causes exactes de la mutation génétique à l’origine de la LMA restent floues. Toutefois, des facteurs de risque bien identifiés sont associés à cette maladie.

Parmi les causes reconnues, on trouve l’exposition à des niveaux élevés de radiations, de benzène ou les deux. Par exemple, des accidents nucléaires peuvent accroître le risque de LMA chez les personnes exposées.
De même, certaines professions, comme celle de pilote, peuvent exposer les travailleurs à des niveaux de radiation plus élevés en raison de leur altitude. L’exposition au benzène, un solvant industriel présent dans le pétrole brut et l’essence, est également un facteur de risque connu.
D’autres éléments, tels que le tabagisme, certaines maladies génétiques comme l’anémie de Fanconi, et l’utilisation de certains médicaments de chimiothérapie pour traiter d’autres formes de cancer, peuvent favoriser le développement de la LMA.
Diagnostic
Le diagnostic de la LMA peut être effectué par divers moyens. En présence de symptômes évocateurs, il est crucial de consulter un professionnel de santé.
Le médecin procédera à un examen clinique complet, incluant :
- les yeux
- bouche
- peau
- ganglions lymphatiques
- foie
- rate
- système nerveux
Des antécédents médicaux et familiaux seront également examinés pour évaluer la présence de facteurs de risque.
Des analyses de sang et des prélèvements de moelle osseuse seront réalisés si la LMA est suspectée. Les échantillons de moelle osseuse peuvent être prélevés de deux manières :
- Aspiration de la moelle osseuse : extraction du liquide médullaire à l’aide d’une aiguille
- Biopsie : prélèvement d’un petit morceau d’os et de moelle avec une aiguille plus grosse
Si la LMA est suspectée d’affecter le cerveau, un liquide céphalo-rachidien sera prélevé par ponction lombaire pour analyse.
Des analyses de sang
Les examens sanguins sont cruciaux pour déterminer le type de leucémie présente. Ils peuvent inclure :
- Numération sanguine complète, pour évaluer le nombre de globules blancs
- Frottis sanguin périphérique, pour analyser la morphologie des cellules
- Tests biochimiques et de coagulation, pour déceler des problèmes hépatiques ou rénaux
- Cytochimie, pour identifier le type de leucémie et son pronostic en utilisant des colorants
- Cytométrie en flux et immunohistochimie, pour classer le type de leucémie
- Cytogénétique pour observer les anomalies chromosomiques
- Hybridation fluorescente in situ (FISH) pour détecter des altérations chromosomiques
- Réaction en chaîne par polymérase (PCR) pour suivre les mutations génétiques dans de rares cellules, par exemple chez des patients en rémission
Des examens microscopiques permettent d’évaluer l’apparition et la fréquence des blastes dans le sang. Pour poser un diagnostic de LMA, le pourcentage de blastes doit être supérieur à 20 % dans le sang ou la moelle.
Traitement
Les traitements de la LMA incluent principalement la chimiothérapie et, dans certains cas, la radiothérapie. La chimiothérapie constitue le traitement principal pour cette pathologie.
Une greffe de moelle osseuse peut également être envisagée dans certaines situations.
Les étapes du traitement
Le traitement de la LMA se déroule en deux phases : la thérapie d’induction et la thérapie post-rémission, aussi appelée thérapie de continuation.
La thérapie d’induction implique des doses intensives de médicaments de chimiothérapie, dont :
- idarubicine
- daunorubicine ou mitoxantrone associée à la cytarabine
- thioguanine
Ces médicaments visent à atteindre la rémission en détruisant les cellules cancéreuses. Généralement, ces traitements sont administrés par voie intraveineuse ou sous forme de comprimés.
Les effets secondaires de la chimiothérapie peuvent être sévères et inclure :
- chute de cheveux
- nausées
- diarrhée
- infections graves
Une hospitalisation d’environ une semaine peut être nécessaire pour gérer ces effets indésirables. En raison de la nature immunodéprimée de ces patients, des infections peuvent survenir plus facilement.
Le médecin peut alors continuer à administrer des chimiothérapies et des antibiotiques pour contrôler les infections.
La rémission complète se définit par l’absence de signes de leucémie, bien que des cellules cancéreuses puissent encore être présentes dans l’organisme.
À ce stade, le patient entre dans la deuxième phase du traitement. Environ deux patients sur trois suivant un traitement standard de chimiothérapie atteindront une rémission.
La thérapie post-rémission a pour but d’éliminer toutes les cellules leucémiques résiduelles. Cela nécessite souvent des doses élevées de chimiothérapie.
Le traitement peut inclure une combinaison des médicaments suivants :
- cyclophosphamide
- idarubicine
- étoposide
- daunorubicine
- mitoxantrone
- cytarabine
Si la chimiothérapie est généralement efficace, le pronostic dépend également de facteurs tels que l’âge et les caractéristiques génétiques du patient.
La récurrence de la LMA, c’est-à-dire la réapparition de la maladie après une période de rémission, est souvent observée peu de temps après l’achèvement du traitement. Cela est rare après une longue période sans signes de maladie.
Il est essentiel de poursuivre les examens diagnostiques tous les quelques mois pendant plusieurs années après le traitement afin de détecter une éventuelle récidive et d’identifier les effets secondaires potentiels de la chimiothérapie.
Sans traitement, l’espérance de vie après un diagnostic de LMA est en moyenne d’environ 8 mois. Le coût du traitement peut dépasser 60 000 $, rendant crucial la vérification de la couverture d’assurance pour ces soins. Les politiques d’assurance qui couvrent le traitement du cancer devraient inclure la leucémie.
Recherche et perspectives en 2024
La recherche sur la leucémie myéloïde aiguë continue d’évoluer, avec des études récentes mettant en lumière de nouvelles approches thérapeutiques. En 2024, des traitements innovants, tels que l’immunothérapie et les thérapies ciblées, montrent des résultats prometteurs pour améliorer les taux de rémission et réduire les effets secondaires. Par exemple, des essais cliniques sur des inhibiteurs de la tyrosine kinase et des agents épigénétiques offrent de nouvelles perspectives pour les patients qui ne répondent pas aux traitements classiques.
Des études récentes révèlent également des biomarqueurs spécifiques qui pourraient aider à personnaliser le traitement en fonction des caractéristiques génétiques des tumeurs, permettant ainsi une approche plus ciblée et efficace. L’évaluation continue des stratégies de traitement et le suivi des patients à long terme sont cruciaux pour améliorer les résultats et la qualité de vie des personnes atteintes de LMA.








